
- 22 高校采購信息
- 329 科技成果項目
- 12 創新創業項目
- 0 高校項目需求
酶催化的原子轉移自由基聚合(ATRPase)和金屬配位交聯方法成功制備出納米人工多酶凝膠體系


常見的納米酶大多數是金屬化合物納米顆粒,其催化活性主要是來自在納米顆粒表面的金屬離子。在自然界中,生物酶的特征表明活性位點和支持、穩定活性位點的網絡環境對于高催化效率同樣重要。通過調整活性位點的成分和環境可以實現高的活性和選擇性。水凝膠是一類具有良好生物相容性的三維親水網絡材料,其結構可以有效地保護酶分子活性中心,同時提供更好的底物遷移微環境,從而實現有效的催化作用,載酶水凝膠材料已成為生物學研究中的熱點。納米凝膠為水凝膠的納米粒子,具有類似于宏觀水凝膠材料的親水網絡及類似流體的傳輸特性,其納米的尺寸可以作為進一步體內生物應用的理想載體。在受限的納米空間中實現修飾或組裝以獲得雜化納米凝膠仍然存在挑戰。
應對這一挑戰,同濟大學化學科學與工程學院王啟剛團隊從仿生的角度出發,設計了一種酶催化的原子轉移自由基聚合(ATRPase)和金屬配位交聯方法成功制備出納米人工多酶凝膠體系。該體系具有模擬超氧化物歧化酶(SOD-like)和過氧化物酶(POD-like)特性,可以實現腫瘤微環境級聯催化的響應成像。日前,相關研究成果以“Multienzyme‐Mimic Nanogels Synthesized by Biocatalytic ATRP and Metal Coordination for Bioresponsive Fluorescence Imaging”為題,發表在國際著名學術期刊 Angewandte Chemie International Edition (《德國應用化學》) 上。同濟大學化學科學與工程學院為該文的唯一通訊作者單位,碩士生齊美園為第一作者,王霞副教授和王啟剛教授為共同通訊作者。
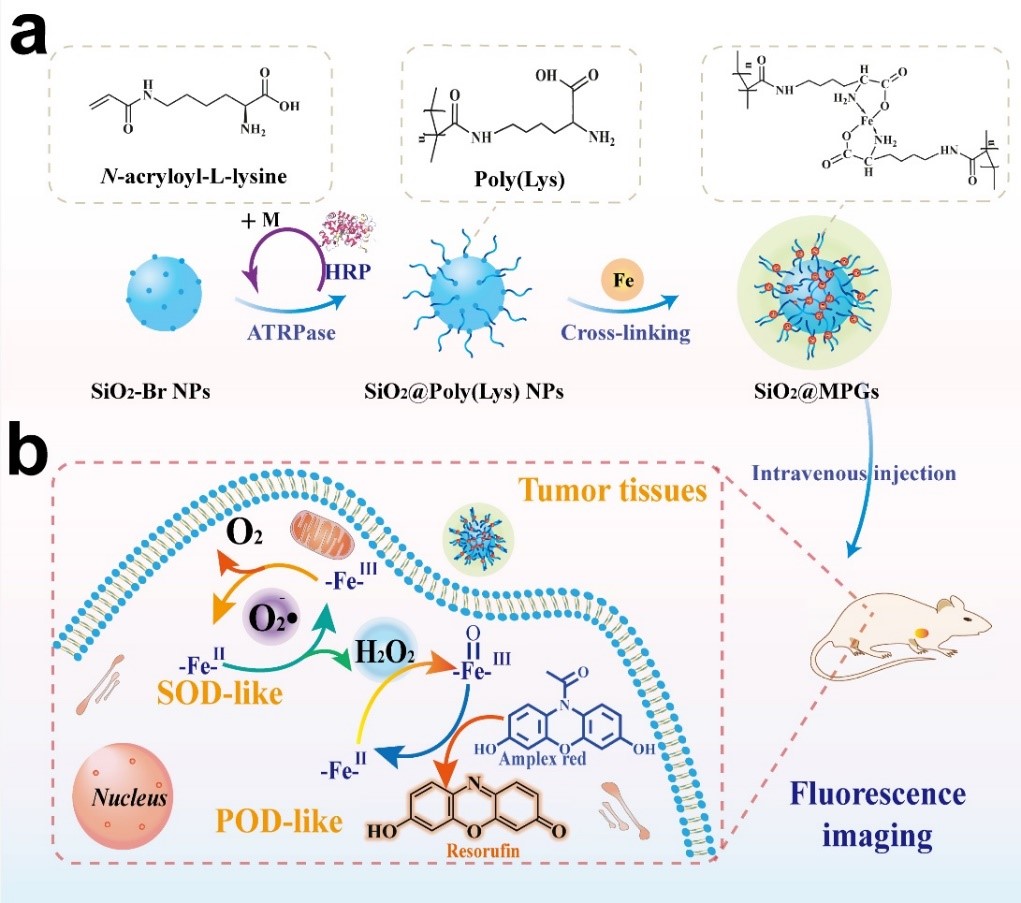
圖1.(a)人工多酶凝膠體系的ATRPase及配位交聯制備流程
(b)模擬SOD和POD級聯酶催化的腫瘤微環境響應的熒光成像機制。
研究人員首先在納米粒子表面修飾酶催化的原子轉移自由基聚合的引發劑(-Br),以具有良好生物相容性的生物酶為催化劑,修飾有雙鍵的賴氨酸(N-acryloyl-L-lysine)為聚合單體,在納米粒子周圍聚合制備得到聚賴氨酸高分子刷,最后通過亞鐵配位交聯,從而構建出具有多酶活性的人工多酶凝膠體系(如圖1所示)。凝膠體系中高分散的Fe離子一方面作為凝膠網絡的交聯劑,同時作為模擬酶的活性中心。通過模擬SOD和POD酶,先將腫瘤部位高水平的O 2 ?? 催化轉化為H 2 O 2 ,進一步基于腫瘤部位提升的H 2 O 2 通過級聯酶催化反應實現腫瘤微環境響應的安全、高效的腫瘤成像。該人工多酶凝膠體系類似自然的過氧化物酶催化機制不產生羥基自由基,具有低毒性和高生物安全性。同時,ATRPase方法和金屬配位交聯技術可進一步實現多種納米材料體系的制備,用于藥物輸送和其他生物醫學應用。
該研究成果得到了國家自然科學基金、國家重點研發計劃等經費支持以及中國科學院強磁場科學中心的技術支持。王啟剛教授團隊多年來一直致力于高分子凝膠固定酶技術及其生物診療應用,近5年累計以通訊作者在 Adv.Mater. , Nat. Commun. , Angew. Chem. Inter. Ed. 等期刊發表SCI論文50多篇。
文獻鏈接:https://www.onlinelibrary.wiley.com/doi/abs/10.1002/anie.202002331
課題組網站:

掃碼關注,查看更多科技成果






