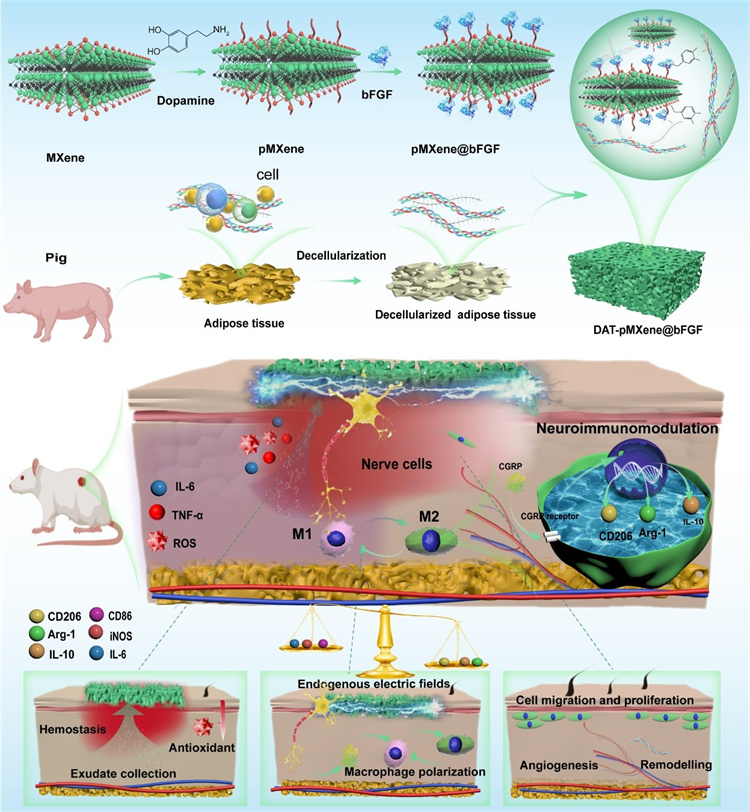
糖尿病性傷口的病理微環境主要表現為增強的炎癥反應和持續的促炎巨噬細胞活性,顯著阻礙了傷口愈合過程。外源性電刺激(ES)通過調節傷口中的電場分布,在治療炎癥性傷口方面顯示出顯著潛力。然而,這種方法依賴于額外的電源和復雜的電路設計。鑒于此,同濟大學附屬第十人民醫院鄭龍坡教授團隊提出了一種仿生神經免疫調節(BNIR)系統,通過收集離子流重塑內源性電場(EFs)。相關研究成果于1月25日在線發表于《生物活性材料》(Bioactive Materials),論文題為“Endogenous electric field-driven neuro-immuno-regulatory scaffold for effective diabetic wound healing”。

該研究受皮膚組織的電生理環境和結構的啟發,提出了一種基于MXene的DAT支架(一種仿生神經免疫調節系統,即BNIR系統)用于增強糖尿病性傷口愈合。該研究中,聚多巴胺修飾的MXene具有顯著的穩定性和抗氧化性能,同時保持其導電性。PDA涂層能夠有效地連接成纖維細胞生長因子(bFGF)。此外,通過冷凍干燥技術構建了一個3D DAT海綿支架,旨在處理傷口滲出液和止血。pMXene@bFGF賦予了3D DAT海綿支架導電性、抗氧化性能和提供了生物活性因子。在體外實驗中,BNIR系統不僅表現出良好的生物相容性,還顯著促進細胞增殖、血管生成和遷移。BNIR系統通過神經免疫調節誘導M1巨噬細胞向M2巨噬細胞的轉變。此外,通過糖尿病大鼠模型系統地研究了復合支架加速糖尿病性傷口愈合的潛力。BNIR系統實現了傷口有效的愈合,展示了聚集傷口滲出液、耦合內源EFs、神經免疫調節、清除ROS和傳遞bFGF在加速糖尿病性傷口愈合方面的治療益處。最后,BNIR系統對于再生其他電敏感組織,包括心臟、骨組織等,也具有重要的潛力。
鄭龍坡教授為論文的第一通訊作者,同濟大學附屬第十人民醫院為第一通訊單位,同濟大學附屬第十人民醫院李穎川教授、杜建忠教授和復旦大學附屬口腔醫院曹文濤副研究員為論文共同通訊作者;同濟大學2021級博士研究生劉志清、王天龍,2022級博士研究生趙錦輝及同濟大學附屬第十人民醫院張雷副主任醫師為論文的共同第一作者。該研究得到國家重點研發計劃、國家自然科學基金、上海市2023年度“科技創新行動計劃”生物醫藥科技支撐專項、上海市自然基金面上項目資助。







