化學動力治療(Chemodynamic therapy,CDT)是一種基于芬頓或類芬頓反應產生具有極強氧化性的羥基自由基(·OH) 、通過介導體內氧化性損傷來殺傷腫瘤細胞的新興抗腫瘤策略。盡管CDT在對病灶組織的空間特異性和對正常組織的低毒副作用方面優勢明顯,但在實現臨床應用之前,一系列問題亟待解決:大部分芬頓或類芬頓反應需要合適的酸性環境、高催化活性的過渡金屬離子、以及足夠濃度水平的過氧化氫(H2O2)等條件,而腫瘤微環境(TME)通常無法提供這些條件。以鐵離子介導的芬頓反應為例,其最佳pH值通常在2.0-5.0之間,而TME(pH值為6.5-7.0)的酸性不夠,導致反應無法有效進行;就催化活性而言,Fe2+的活性比Fe3+更高、卻又更不穩定;盡管腫瘤細胞內的H2O2濃度水平一般而言高于正常細胞,但也不足以確保芬頓反應的高效進行。如何在腫瘤病灶部位為芬頓反應創造上述關鍵性條件成為了推動CDT實用化的決定性因素之一。鑒于芬頓反應的內在機制以及葡萄糖氧化酶(GOx) 能在生理條件下催化將β-D-葡萄糖氧化成葡萄糖酸(酸化微環境)的反應并生成H2O2,GOx可能是為芬頓反應創造關鍵性反應條件的理想介質。分子光開關是一類能經光觸發在兩種狀態之間進行轉換的有機小分子,其開關轉換常伴隨著構象、極性和親疏水性等特征的變化。受自然界中一些分子光開關介導/影響特定生物過程的啟發,中國科學院大學田志遠教授團隊首次基于螺吡喃分子光開關的開關轉換實現了對GOx催化活性的光學操控,在此基礎上結合光誘導Fe3+的還原反應實現了光觸發三重因素協同提高芬頓反應效率,以此強化CDT效力進而強效抑瘤。初步研究成果以“Molecular Photoswitching Unlocks Glucose Oxidase for Synergistically Reinforcing Fenton Reactions for Antitumor Chemodynamic Therapy”為題發表在Angewandte Chemie International Edition (Angew. Chem. Int. Ed. 2024, e202413633)上。
螺吡喃分子可經紫外光和可見光觸發在閉環結構(螺吡喃)和開環結構(部花青)之間進行可逆轉換。分子對接模擬結果表明,螺吡喃能夠通過與GOx催化位點處的殘基Thr110之間的強相互作用進而“占據”該活性位點;相比而言,部花青與Thr110之間的相互作用能明顯降低,表明螺吡喃與GOx活性位點的結合更為穩定。此外,螺吡喃光異構化為部花青后產生了一個極性基團(硝基苯酚),可促進與GOx活性口袋外圍殘基Tyr68和Arg512的氫鍵或靜電相互作用;這種結合相互作用的顯著變化有望能為部花青從活性袋中脫離提供足夠的驅動力,從而為葡萄糖與GOx活性位點的對接和隨后的酶促反應留下空間。基于上述設計思想,他們構建了以Fe3+為中心離子的金屬有機框架(Fe(Ⅲ)-MOF)為納米平臺并負載了GOx的新型納米顆粒制劑。經SP預鈍化的GOx在有機體內的運輸過程中保持“靜默”狀態,可以避免其對正常組織中產生毒副作用;在病灶部位,納米顆粒中GOx的催化活性通過光觸發螺吡喃向部花青的轉換得以被激活。另一方面,通過Fe3+-Fe2+光還原作用誘導Fe(Ⅲ)-MOF結構的崩解進而釋放出游離的Fe2+/Fe3+離子;其中Fe3+通過水解過程使微環境酸化,與GOx介導的酶促反應的產物葡萄糖酸共同酸化腫瘤微環境。基于以上光開關和光還原過程,光還原產物Fe2+和酶促反應的另一種產物H2O2在酸性介質中發生芬頓反應生成強氧化性·OH,通過對腫瘤細胞內的蛋白產生氧化性損傷進而達到抑制腫瘤的效果。
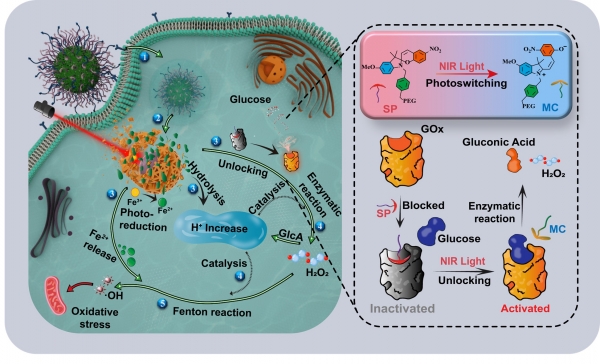
圖1 光學活性復合納米制劑的構建,以及其基于光化學開關解鎖葡萄糖氧化酶的活性、光還原反應原位生成高反應活性的金屬離子為芬頓反應提供三重條件,以此為基礎產生強氧化性羥基自由基、實現對線粒體的氧化性損傷進而導致腫瘤細胞死亡。
中國科學院大學化學科學學院博士研究生王梓丞、鮑威爾(現為中國科學院大學特聘研究助理)、吾杰提為該論文的共同第一作者,田志遠教授、崔巍副教授為共同通訊作者。相關研究工作得到了國家自然科學基金、博士后科學基金、中國科學院大學博士后與專職科研崗位人員特別支持項目的支持;中國科學院過程工程研究所生化工程國家重點實驗室馬光輝院士/魏煒研究員團隊在動物實驗方面給予了大力支持和幫助。
近年來,田志遠教授團隊與生化工程國家重點實驗室、上海交通大學附屬同仁醫院、吉林大學附屬中日聯誼醫院臨床醫生團隊密切合作,立足于新型光學活性材料的設計構建在腫瘤診療一體化、多模態協同抑瘤等方面開展了一系列多學科交叉研究。他們在通過瘤內時-空可控的原位光酸化過程誘導產生氧化應力和鈣過載、基于兩種不同機制的協同實現線粒體的雙重損傷和腫瘤細胞死亡(Nature Communications, 2021, 12, 6399);基于光熱轉換及血小板熱敏性功能、實現光熱治療與免疫治療協同的復合仿生抑瘤制劑的設計構建及高效抑瘤并有效防止腫瘤轉移和復發(Science Advances, 2021, 7 : eabd7614);基于全腫瘤細胞疫苗的構建通過近紅外光觸發按需調控機體的免疫響應實現高效抑瘤 (Nature Communications, 2023, 14, 4505);設計構建能特異性靶向腫瘤相關成纖維(CAFs)、經雙重機制介導產生·OH誘導免疫原性細胞死亡并逆轉免疫抑制腫瘤微環境進而實現高效協同抑瘤的復合納米制劑(Small, 2024, 20, 2304491,扉頁文章) 等方面取得了一系列研究成果。
文章鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202413633







