2013年,科學家首次證明CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)技術可以在哺乳動物細胞內實現高效的基因組編輯。自此之后,該技術快速發展,為生物醫學基礎研究和臨床應用提供了新模式。
對一個基因編輯方案的技術評估包括編輯效率、編輯安全性(即脫靶效應)和遞送效率三個方面。但在以臨床應用為目標的應用場景中,其中的編輯安全性則通常被第一優先考慮。就在今年的8月和11月,FDA先后暫停了Beam Therapeutics的CAR-T體外基因編輯治療IND申請和Verve Therapeutics的PCSK9體內基因編輯治療管線的一期臨床試驗,要求新藥研發機構提供更多的數據,評估在利用基因編輯技術展開治療的過程中相關的脫靶編輯風險,以及由此帶來的染色體易位風險。
由于CRISPR系統巨大的臨床應用潛力,對于基因編輯過程中脫靶效應進行評估的探索,幾乎與CRISPR系統被證實可以應用于編輯哺乳動物基因組同時出現。至今為止,科學家們已經開發了諸多方法來評估基因編輯過程中伴隨發生的潛在脫靶編輯事件。這些方法可以分析不同基因編輯場景下的基因組DNA,一般被歸納為細胞外(in vitro,如Circle-seq)、體外培養細胞中(in cellula,如GUIDE-seq)、體內組織細胞中(in vivo,如Discover-seq)三類。這些方法的共同思路,是在基因編輯過程中,將所有被編輯位點(包括靶點和脫靶位點)打上“標簽”,再通過對帶標簽基因組序列的富集來檢測基因組的哪些區域發生了CRISPR相關的基因編輯。
作為目前被較廣泛使用的方法,GUIDE-seq通過在基因編輯的過程中給細胞內加入大量外源dsODN(double-stranded oligodioxynucleotide)來完成加標簽的過程。但是,由于外源dsODN對細胞具有毒性,使得GUIDE-seq無法被應用于體內基因編輯的脫靶檢測。另一種被報道可以用于體內檢測的Discover-seq技術,則通過對DNA修復蛋白MRE11的免疫共沉淀,來鑒定脫靶編輯發生的基因組位置。因此,其能夠找到的脫靶編輯位點僅限于某一個時間點上細胞內正在修復中的DNA雙鏈斷裂處的瞬時快照,而不能夠反應整個編輯時間窗口中發生的所有編輯事件。
西湖大學生命科學學院馬麗佳研究員和團隊成員們也一直在尋找新方法,希望克服以上缺點,優化基因編輯脫靶位點的檢測。
“PEAC-seq adopts Prime Editor to detect CRISPR off-target and DNA translocation”于2022年12月12日在線發表在Nature Communications。
論文鏈接:https://www.nature.com/articles/s41467-022-35086-8
原文截圖
Prime Editor(PE)是David Liu博士研究小組于2019年發表的一種新型基因編輯工具,其本身的應用場景是基因編輯而非鑒定脫靶位點。PE系統將Cas9 nickase(Cas9n)和逆轉錄酶MMLV融合,并創新性地將想編輯成的DNA信息添加在gRNA的3’端(pegRNA)作為逆轉錄酶的反轉錄模板,通過反轉錄,目標DNA序列會被引入基因組。在隨后的幾年里,通過David Liu、Caixia Gao等實驗室的一系列優化工作,PE系統目前已經能夠達到非常高的編輯效率。
受此啟發,馬麗佳實驗室的研究人員對PE系統進行了改造。首先,他們將pegRNA上的反轉錄模板改造為一段優化過的固定插入序列(tag)。在PE系統的作用下,發生了編輯的基因組位點都會帶有這段標簽序列。隨后,他們改用野生型Cas9而非Cas9n與MMLV融合,使得檢測到的脫靶編輯都來自于Cas9引起的雙鏈DNA斷裂。最后,在Tn5轉座酶的配合下,利用兩對富集引物,所有帶有tag的基因組位置通過PCR反應被富集,并最終從高通量測序數據中被鑒定出來。整套方案被命名為PEAC-seq(圖1),為Primer Editor Assisted off-target Characterization by sequencing的縮寫。
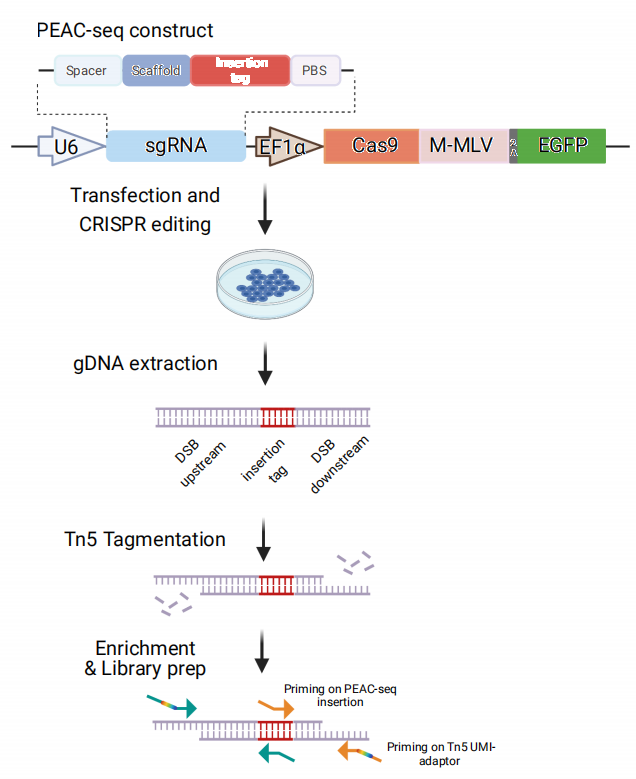
圖1 PEAC-seq流程圖
研究人員在HEK293T細胞中選擇了六個被廣泛用于測試脫靶編輯的位點,將PEAC-seq鑒定到的脫靶位點與GUIDE-seq的檢測結果進行比較,并通過Amplicon-seq進行驗證,發現PEAC-seq與GUIDE-seq的結果具有很好的一致性。
在對PEAC-seq的測序信號進行仔細查驗的過程中,研究人員意外地發現在某些脫靶位點,有部分信號不是來自于該位點本身隨PE系統被插入的PEAC-seq tag。由于tag的插入具有方向性,兩對用于富集tag的PCR引物各自只能擴增出tag上游、或者是tag下游的基因組序列。隨著分析的深入,研究人員推測異常信號很可能來自于基因組中多個被編輯位點在各自發生DNA雙鏈斷裂后,由于在三維空間上靠近,而產生易位連接在一起,并提出了在PEAC-seq系統中,幾種可能發生的DNA易位連接模式(圖2)。

圖2 PEAC-seq檢測DNA translocation的五種可能情況(底部粉色圖形表示異常信號)
經過驗證,研究人員證實了他們的猜測,發現染色體易位情況在很多靶位點(on-target)和脫靶位點(off-target)上都存在(圖3)。但染色體易位的發生概率與位點本身的編輯效率并沒有明顯正相關,提示了有其他因素的影響。相比于脫靶效應,染色體易位帶來的基因組毒性會影響更大范圍的基因表達,造成細胞功能的異常。然而,以往的基因編輯脫靶檢測方法,需要通過已知的基因組上下游序列、逐個位點去鑒定染色體易位,無法對染色體易位情況進行全基因組評估。PEAC-seq彌補了這方面的不足,為系統性鑒定由基因編輯引起的染色體易位提供了解決方案,也為更為安全地實施基因編輯提供了參考依據。

圖3 Identification and validation of DNA translocations
最后,研究人員將體外轉錄的Cas9-MMLV的mRNA和pegRNA通過顯微注射的方式,遞送入小鼠受精卵中,一段時間后收集小鼠胚胎檢測脫靶編輯情況。這個實驗驗證了PEAC-seq在體內基因編輯場景中也可以被安全地用于檢測脫靶位點(圖4)。
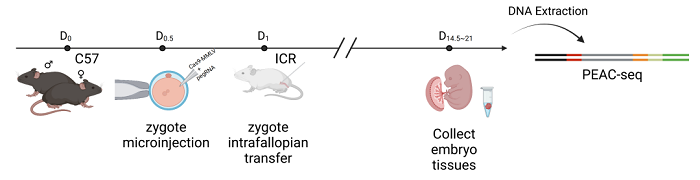
圖4 PEAC-seq in vivo application
研究人員還對基因組中脫靶編輯和染色體易位發生的規律展開了進一步分析。他們發現,發生脫靶編輯的位點,與被基因編輯的細胞系中代表染色體開放區域((ATAC-seq)、基因的轉錄調節區域(H3K4me3,H3K9ac,and H3K27ac,POLR2A,EP300,H2AFZ)的信號具有明顯的共富集。而染色體易位,則與細胞本身的雙鏈斷裂熱點具有共富集。
總之,PEAC-seq提供了一種新型的Cas9基因編輯脫靶位點檢測方案,在體外培養細胞和體內受精卵中都被證明可以安全、準確地鑒定出脫靶位點。更重要的是,PEAC-seq為基因編輯引起的染色體易位鑒定提供了解決方案。隨著基因編輯技術被應用在越來越多的基因治療臨床試驗中,之前被忽視的染色體易位現象需要在靈敏的檢測方法所產生的數據支持下,被更為深入地分析。







