卵巢癌是一種常見的婦科腫瘤,病死率在婦科腫瘤中一直居于首位。基于鉑類藥物的化療是卵巢癌的一線療法。鉑類藥物早期療效顯著,但多數(shù)患者最終會因?qū)︺K類藥物的耐藥而出現(xiàn)腫瘤復發(fā)。闡明卵巢癌鉑耐藥機制對于提高卵巢癌的治療水平具有重要的理論和臨床實踐意義。一直以來,圍繞著藥物運輸、DNA損傷修復、細胞存活通路調(diào)節(jié)等方面,研究人員開展了大量關于卵巢癌鉑耐藥的基礎研究,極大地拓展了對于卵巢癌鉑耐藥的認識,但是目前的研究也存在臨床轉(zhuǎn)化潛力不足,機制解析不系統(tǒng)的問題。進一步貼近臨床并系統(tǒng)闡明鉑耐藥機制是卵巢癌的重要研究方向。
近日,中山醫(yī)學院生化教研室潘超云副教授團隊在國際腫瘤學經(jīng)典期刊 Oncogene (IF: 9.867) 在線發(fā)表了題為:ROS-regulated phosphorylation of ITPKB by CAMK2G drives cisplatin resistance in ovarian cancer的研究論文。這是潘超云副教授繼2019年6月和2019年10月在The Journal of Clinical Investigation、2021年8月在Nature Communications 發(fā)表的關于卵巢癌鉑耐藥機制研究的系列文章后,又一研究成果。
潘超云副教授團隊利用商業(yè)化激酶抑制劑庫對臨床相關的激酶靶點進行高通量順鉑合成致死篩選,發(fā)現(xiàn)鈣/鈣調(diào)蛋白依賴性蛋白激酶 II (CAMKII)是促進卵巢癌鉑耐藥的重要激酶,抑制CAMKII可顯著增強卵巢癌對順鉑的敏感性。
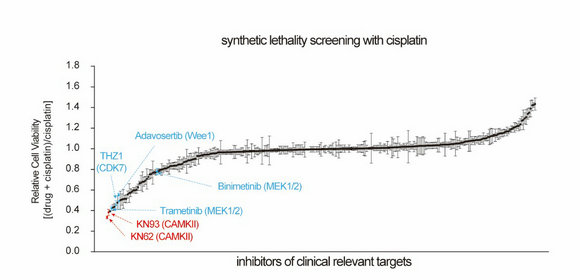
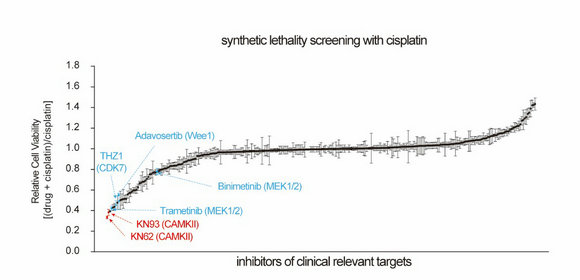
圖示:通量順鉑合成致死篩選發(fā)現(xiàn)CAMKII靶點
研究團隊對CAMKII 促進卵巢癌鉑耐藥的機制進行系統(tǒng)解析,發(fā)現(xiàn):CAMKII 同工酶 CAMK2G 在維持順鉑殺傷下的卵巢癌細胞內(nèi)氧化還原穩(wěn)態(tài)的調(diào)控中發(fā)揮重要作用;CAMK2G是鉑耐藥卵巢癌細胞內(nèi)重要的ROS感受器。通過代謝分析、質(zhì)譜、shRNA篩選等實驗,研究發(fā)現(xiàn)卵巢癌細胞內(nèi)源性的ROS升高并直接氧化修飾CAMK2G Met281/Met282 位點導致CAMK2G啟動激活(priming)。啟動激活后的CAMK2G直接磷酸化下游激酶ITPKB S174位點而增強ITPKB激酶活性,提高細胞內(nèi)ITPKB的代謝產(chǎn)物磷酸肌醇IP4的水平。而高水平的IP4顯著限制了順鉑誘導下的NOX4活性的急劇上升,降低NOX4產(chǎn)生的ROS水平,避免ROS誘發(fā)啟動細胞凋亡。而NOX4產(chǎn)生的低水平ROS進一步刺激CAMK2G-pITPKB 的活化,從而在反饋回路中抑制順鉑誘導的NOX4激活,促進鉑類藥物殺傷下細胞內(nèi)的氧化還原態(tài)的再平衡。因此,通過ROS-CAMK2G-pITPKB -NOX4 的穩(wěn)態(tài)環(huán)路,沒有殺死卵巢癌細胞的鉑類藥物可能使卵巢癌細胞耐藥程度變的更強,ROS-CAMK2G-pITPKB-NOX4 通路揭示了一種典型的固有以及獲得性鉑耐藥的混合機制。
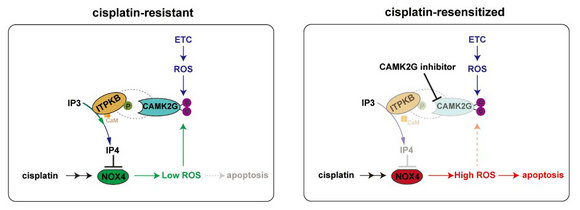

圖示:ROS-CAMK2G-pITPKB -NOX4 環(huán)路促進卵巢癌氧化還原穩(wěn)態(tài)的作用機制圖
本論文第一作者為中山大學附屬第一醫(yī)院婦產(chǎn)科博士后李潔,碩士生鄭翠苗對本項研究有重要貢獻,中山醫(yī)學院潘超云副教授是本文通訊作者。該研究得到了中山大學中山醫(yī)學院-附屬第一醫(yī)院先進醫(yī)學技術研究中心、廣東省惡性腫瘤表觀遺傳與基因調(diào)控重點實驗室開放項目、國家自然科學基金以及廣東省自然科學基金等支持。







