近日,中山大學附屬第一醫院神經科邢世會和曾進勝教授研究團隊在自噬與卒中遠隔部位血管新生的研究中取得重要進展。該研究首次闡明Nogo-A通過調節血管自噬活動影響腦梗死后遠隔部位血管新生的分子機制,為卒中后遠隔損害的防治和改善神經功能提供了新的視角。
相關研究成果再次發表在生物學一區期刊Autophagy,文章題目為“RTN4/Nogo-A-S1PR2 negatively regulates angiogenesis and secondary neural repair through enhancing vascular autophagy in the thalamus after cerebral cortical infarction”。中山大學附屬第一醫院神經科邢世會教授和曾進勝教授為論文共同通訊作者,碩士研究生肖佩儀和古錦敏為共同第一作者。
研究人員發現局灶性皮質梗死后,同側丘腦神經元和少突膠質細胞Nogo-A上調并激活其血管上Δ20受體S1PR2通路。運用基因沉默技術阻斷Nogo-A/S1PR2信號通路能夠顯著抑制丘腦血管內皮細胞自噬激活,促進血管新生;反之,激活該信號通路促進梗死同側丘腦血管自噬激活,抑制血管新生。
研究進一步證實Nogo-A/S1PR2通過促進自噬啟動和抑制自噬體降解調控血管自噬流水平。S1PR2受體通路激活后,其下游分子ROCK1與自噬調節蛋白Beclin1相互結合,促進Beclin1磷酸化,從而調節血管自噬活動。阻斷Nogo-A/S1PR2通路促進血管新生能有效保護腦梗死同側丘腦繼發性神經損害,改善大鼠的學習和記憶功能。
該研究獲得國家重點研發計劃和國家自然科學基金等資助。
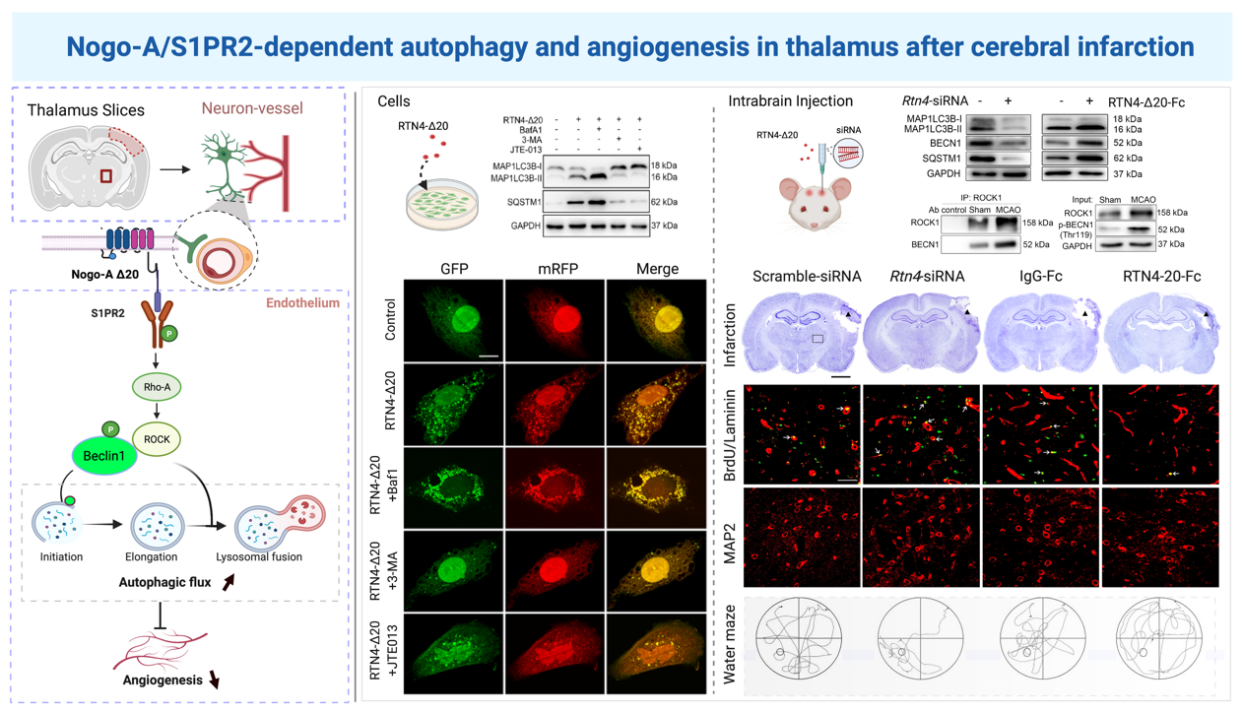
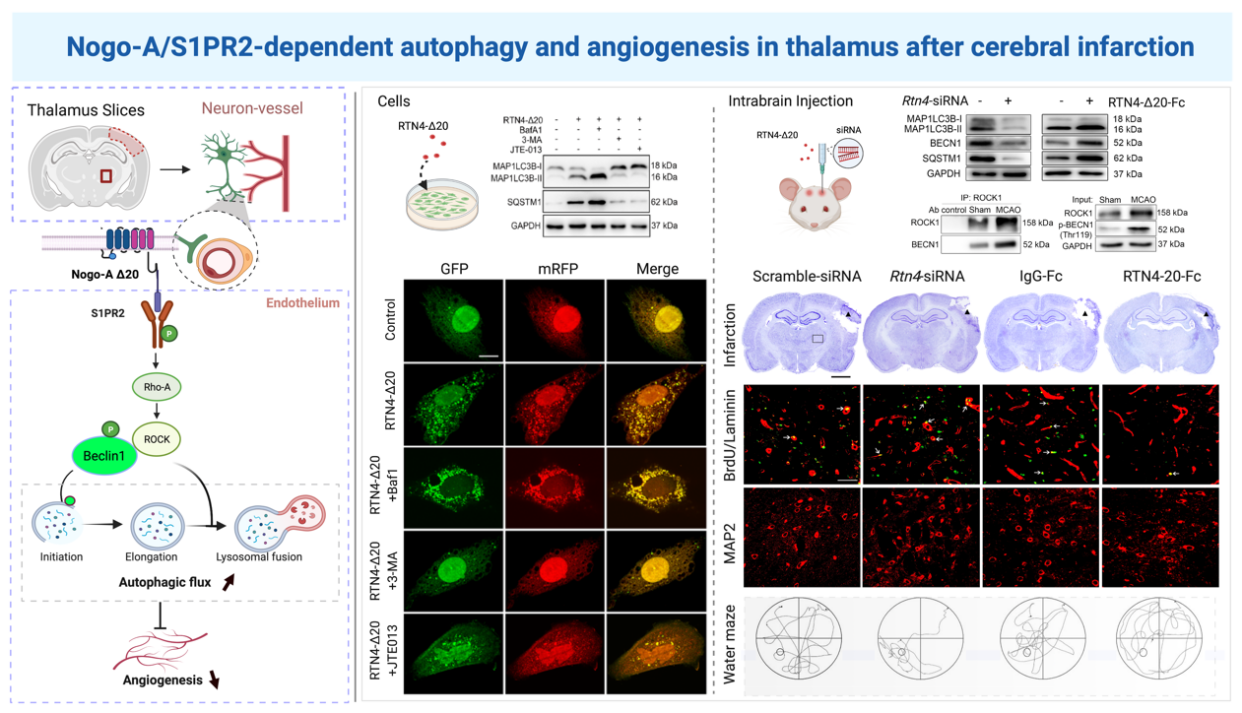
圖(左):Nogo-A/S1PR2信號通路誘導腦梗死遠隔部位血管自噬抑制血管新生作用機制示意圖;
(中):體外實驗證實Nogo-A/S1PR2信號通路調控血管內皮細胞自噬流(Control組、Nogo-A-Δ20組、Nogo-A-Δ20+BafA1組、Nogo-A-Δ20+3-MA組、Nogo-A-Δ20+JTE013組);
(右):Nogo-A/S1PR2信號通路調節血管自噬的分子機制及其對腦梗死后遠隔部位血管新生和神經修復作用(Scramble-SiRNA組、Nogo-A-SiRNA組、IgG-Fc組、Nogo-A-Δ20-Fc組)。







