阿茲海默等多種神經系統疾病病理生理過程中都有神經炎癥的參與。神經炎癥是一種由小膠質細胞和星形膠質細胞介導的免疫反應,會損傷神經元、抑制神經再生,阻礙了疾病的治療和恢復。因此,開發神經炎癥調節類藥物可以降低疾病惡化,改善神經功能,具有十分重要的研究意義和臨床價值。然而,血腦屏障的存在阻止了目前絕大部分藥物進入神經系統發揮抗炎及免疫調節作用,使得藥物開發困難重重。
對此,中山大學附屬第三醫院邱偉教授聯合國家納米科學中心聶廣軍研究員等展開了相關研究。近日,他們在國際知名材料科學期刊Nano Today(中科院一區Top,IF=20.722)發表了題為“Regulation of Neuroinflammation with GLP-1 Receptor Targeting Nanostructures to Alleviate Alzheimer’s Symptoms in Disease Models”的研究論文。國家納米科學中心聶廣軍和王海研究員、河北師范大學常彥忠教授為共同通訊作者,趙宜鵬博士后(中山大學附屬第三醫院)、田絲雨博士(河北師范大學)和張杰博士(國家納米科學中心)為論文共同第一作者。
該研究設計了一種可穿透血腦屏障(BBB)的新型GLP-1受體激動劑納米藥物,能顯著抑制中樞神經系統(CNS)炎性小膠質細胞—星形膠質細胞的激活,調節CNS免疫反應,緩解神經系統功能性損傷。邱偉教授團隊聯合聶廣軍研究員團隊通過PEG2000和腦靶向肽angiopep-2修飾GLP-1受體激動劑-利拉魯肽,開發出新型納米結構藥物pALRGT,使其能夠有效穿透血腦屏障,并在中樞神經系統發揮免疫調節功能。利拉魯肽作為一種GLP-1受體激動劑,能夠通過PI3K-AKT信號通路降低轉錄NF-κB的磷酸化水平,從而抑制小膠質細胞的激活和促炎因子的分泌。此外,利拉魯肽還阻止了活化小膠質細胞引起的反應性星形膠質細胞的生成,并促進IL-3的分泌以恢復小膠質細胞的正常生理功能(圖1)。pALRGT在保留了利拉魯肽中樞免疫調節功能的同時,大大增強對血腦屏障的穿透能力。通過外周注射pALRGT,能夠顯著降低小鼠腦部海馬區域淀粉樣蛋白堆積引起的神經炎癥,緩解神經元損傷,從而改善其認知功能(圖2)。
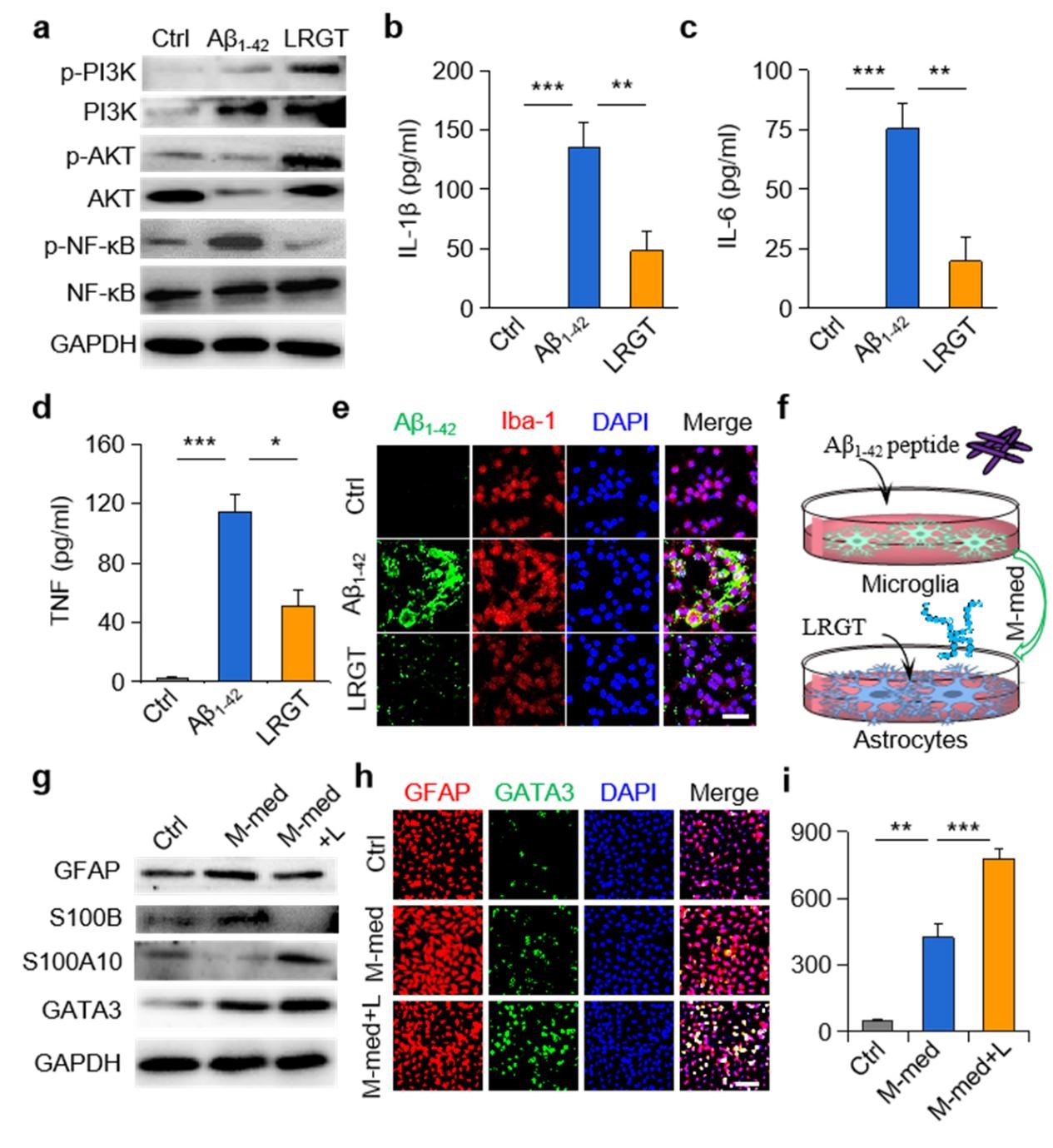
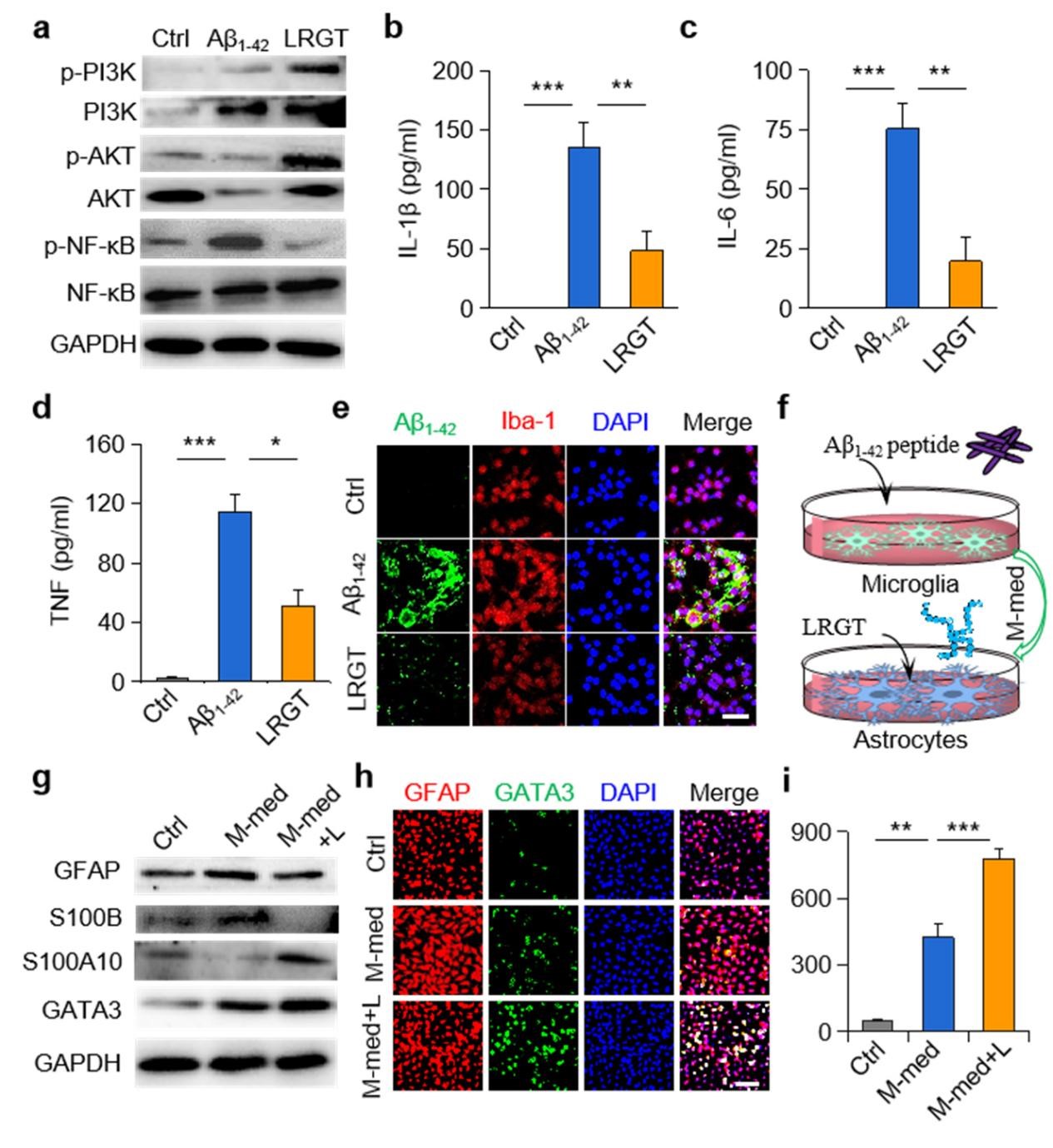
圖1:利拉魯肽降低小膠質細胞NF-κB的磷酸化水平(a),減少促炎因子濃度(b-d)并促進Aβ蛋白的清除(e);利拉魯肽抑制小膠質細胞對星形膠質細胞的激活(f-g),通過轉錄因子GATA3(h)促進IL-3的分泌(i)
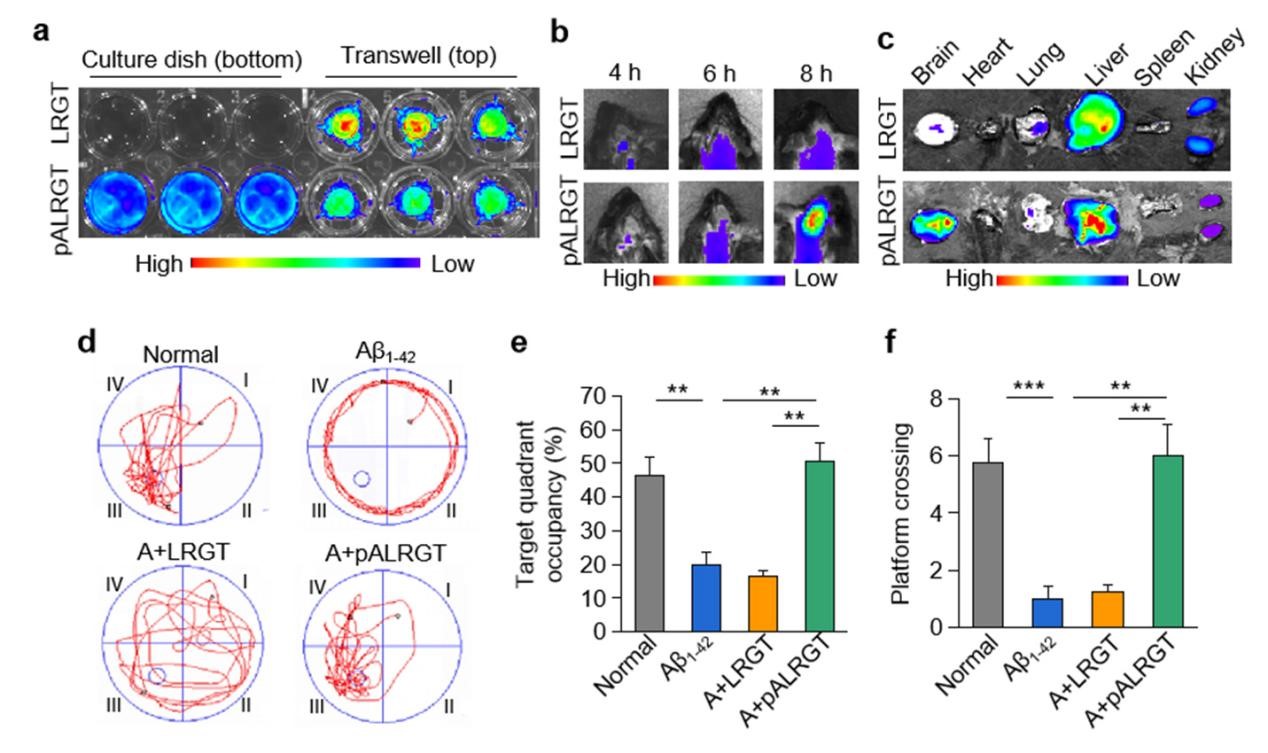
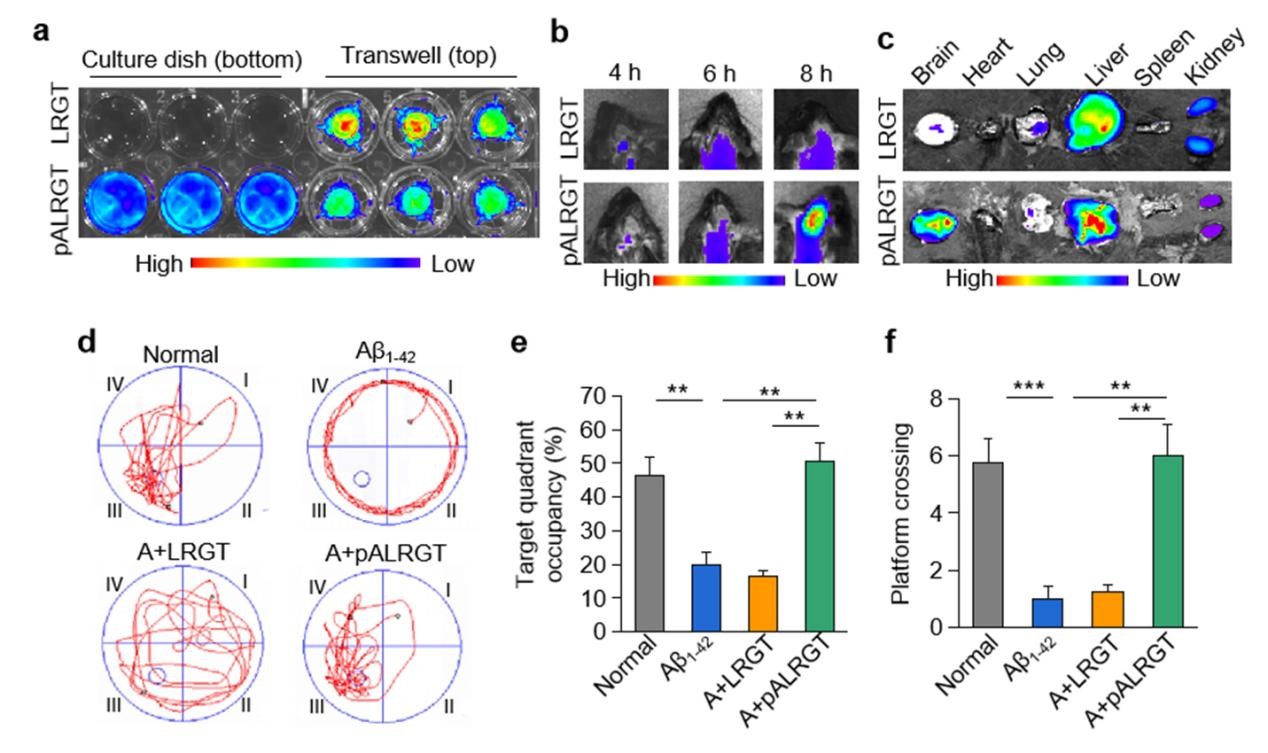
圖2:通過小鼠模型證實,pALRGT能有效穿透血腦屏障(a-c),改善小鼠認知功能(d-f)
該課題系統性地研究了小膠質細胞-星形膠質細胞在免疫炎性環境中的相互作用,證實GLP-1受體激動劑可用于調節小膠質細胞和星形膠質細胞引起的免疫炎癥,pALRGT以其高BBB穿透性、高安全性、合成簡單快速等特點,未來有望有用于神經系統免疫及炎性疾病的臨床治療(圖3)。
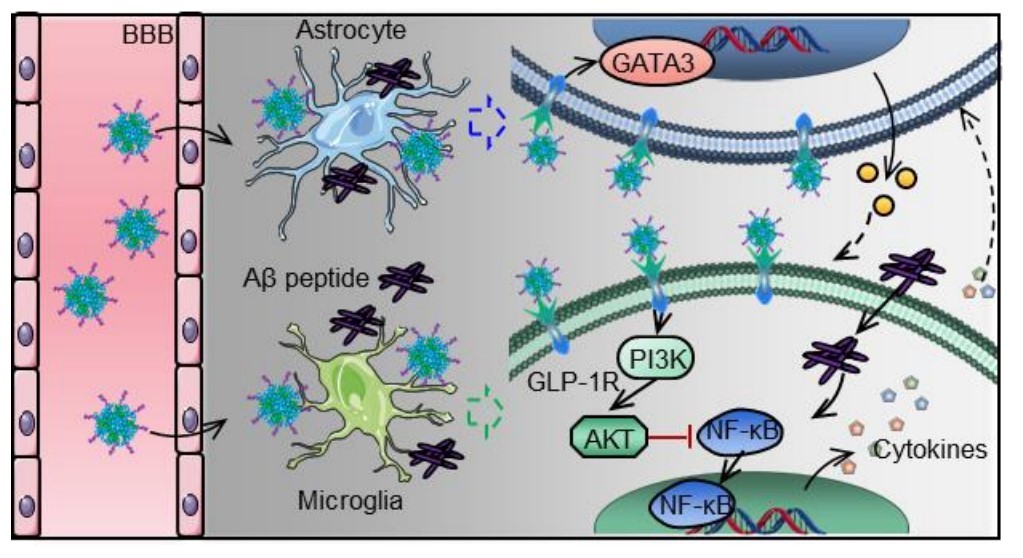
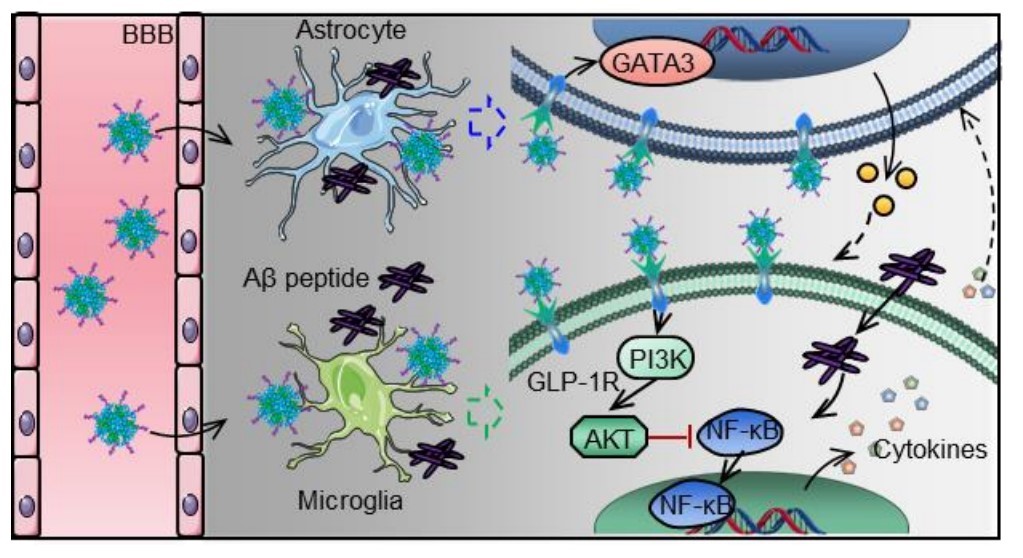
圖3:納米藥物pALRGT穿過血腦屏障,調節中樞神經系統免疫炎癥反應的示意圖
借助納米醫學進行腦病研究已成為科學前沿方向之一。為對接國家腦計劃,2020年10月中山大學附屬第三醫院與廣東粵港澳大灣區國家納米科技創新研究院(廣納院)簽署協議,達成戰略合作關系。2021年2月醫院率先成立“納米醫學中心”,與干細胞(細胞)平臺、大數據人工智能平臺共同組成醫院三大科研支撐平臺,同時聘任國家納米科學中心趙宇亮院士擔任醫院納米醫學中心學術指導委員會主任。本研究即為雙方合作框架下產出的成果。未來醫院腦病中心及納米醫學中心仍將與國家納米科學中心和廣納院共同攜手,充分發揮納米醫學在腦疾病診療中的價值,推動納米醫學研究成果的臨床轉化。







